La chimica, cosi come più in generale la scienza, deve superare il riduzionismo che limita la osservazione circolare in una interpretazione lineare che riduce i sistemi complessi in semplici trasformazioni tra reagenti e prodotti.
Per esempio, quando scriviamo Ab+Cd=Ad+Cb, a proposito di una reazione chimica di doppio scambio, la chimica tradizionale, propria dell’epoca industriale, ha trattato la equazione in termini di rendimento lineare della trasformazione in prodotti, considerando come rifiuti i prodotti di meno valore.
Es . NaCo3 +2HNO3 = NaNO3 + CO2+H2O.
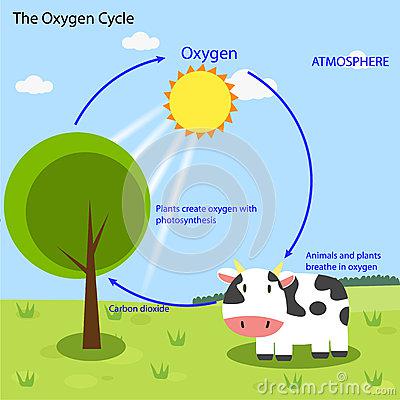
In vero, tutte le trasformazioni chimiche divengono assai complesse, se dobbiamo riutilizzare i prodotti di scarto in modo circolare, come avviene in natura, dove le principali trasformazioni degli elementi che generano la vita nel nostro pianeta corrispondono ad attività di equilibrio ciclico che ben conosciamo; come il Ciclo dell’Acqua, con i suoi cambiamenti di stato (liquido, vapore e ghiaccio); il Ciclo del Carbonio e dell’Ossigeno, tramite la fotosintesi della CO2 delle piante in zuccheri che cibano animali terrestri e pesci nel mare con composti di Carbonio, che poi vengono nuovamente ossidati in CO2; il Ciclo dell’azoto, tramite batteri azoto-fissatori che (come fanno anche i fulmini) trasformano lo N2 dell’aria, in composti ammoniacali o dell’acido nitrico, che poi i batteri de-nitrificatori, in simbiosi con le radici delle piante e di funghi, ritraducono in N2 molecolare; il Ciclo del Fosforo, così importante nel metabolismo della alimentazione, e cosi via dicendo. Infatti il Ciclo di Krebs è di fondamentale importanza per il fabbisogno energetico tradotto in ATP nelle cellule e permette di riutilizzare il Fosforo (P) senza avere la necessità di consumarne grandi quantità.
Circular Economy based on ZERO WASTE STRATEGY
Questa circolarità della chimica in natura e quella che dovrà essere presa in considerazione nel passaggio da una chimica che crea rifiuti ed inquina ad una chimica capace di utilizzare i sottoprodotti di ciascun processo industriale, in modo che lo scarto dell’uno divenga utile per un processo successivo, ciò esattamente come possiamo imparare a fare dalla natura.
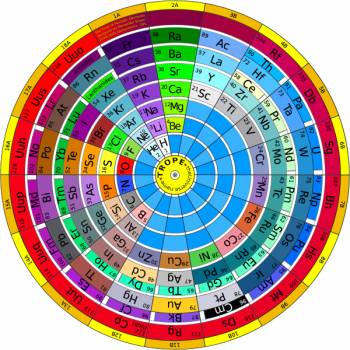
La ciclicita della natura riflette la ciclicità dell’ ordinamento atomico. Infatti la tavola periodica degli elementi realizzata dal Chimico Russo Dmitrij Ivanovič Mendeleev nel 1869, che inizio’ con l’ordinare gli elementi chimici come sequenze di proprietà complementari. Pertanto la prima versione della “tavola periodica” assunse una necessaria forma circolare come conseguenza del fatto che da un lato del cerchio si evidenziano proprietà elettro-positive degli elementi mentre sul lato opposto del cerchio trovano posizione le complementari proprieta elettro-negative (1).
La ragione profonda della “non linearità” della chimica risiede nella dinamica di espansione del fronte di reazione che è visibile facilmente dalla osservazione delle reazioni dette di Belousow Zabotinsky (dette anche reazioni dell’Orologio)(2) e degli Anelli di Liasegang(3), le cui cinetiche chimiche che sono state studiate approfonditamente dal Premio Nobel per la chimica Ilyia Prigogine.
Come un sasso che cadendo nell’acqua crea cerchi concentrici, cosi il “fronte di sviluppo delle reazioni chimiche”, là dove si rende visibile, come nelle reazioni sopra indicate, si comporta circolarmente e non linearmente.


…….. <Clock –reactions> ………….. < Liesegang . Rings> …
Le reazioni dette “dell’Orologio” sono ad esempio le reazioni “RedOx” (di Riduzione e successiva Ossidazione). Esse mostrano un andamento ciclico non solo nella forma circolare dello sviluppo del fronte di reazione, ma proprio nella successione ciclica che avviene ritmicamente nel tempo, dove un indicatore appositamente aggiunto, segnala che la reazione prima si trova in uno stato riducente (Red) a cui segue una fase ossidante (Ox) e ciò fino ad esaurimento dei prodotti cosi che la reazione ha fine.
L’andamento è lo stesso delle onde del mare; quando si alza il vento se osserviamo l’onda dalla riva vediamo che l’acqua avanza sulla sabbia e poi si ritira ritmicamente perseguendo il principio generale ritmico della “azione-reazione”.
Facciamo ora un esempio da laboratorio : se prendo il Cloruro di Cobalto che è di colore rosa, ed aggiungo ammoniaca al 30% in volume e mescolo, come siamo soliti fare noi chimici, ottengo come prodotto il [Co(NH3)6]Cl3. (complesso ammoniacale esavalente ) che è di colore blu, ed un residuo insolubile.
Se però voglio rallentare il processo di reazione per osservare la ciclicità dello sviluppo del fronte di reazione, allora mescolo omogeneamente il CoCl2 in un gel di silice (quest’ultimo è un supporto amorfo e quindi non reagisce), e lo immetto in una provetta che diviene tutta rosa; poi aggiungo la NH3 al 30%, in cima alla provetta. Osservo allora che si formano strati “blu” succeduti da strati che rimangono di color “rosa”, in una sequenza bicolore, dove man mano che la ammoniaca scende per gravità ed adsorbimento del gel, l’andamento ritmico di successione dei due colori si infittisce.
Per quando stupisca questo andamento ciclico dei fronti delle reazioni chimiche, esso è del tutto naturale. Come esempio di clock-reaction in natura possiamo osservare la sezione trasversale di un tronco di albero, la quale ci dice l’andamento delle reazioni di fotosintesi della pianta nel tempo, nella sezione dell’albero viene impressa la traccia di altre interessanti informazioni circolari e ritmiche sulla vita vegetale dell’albero e la sua età e sviluppo dalla nascita.

Tutte queste osservazioni sul comportamento ciclico delle reazioni chimiche, che qui ho brevemente riportato, sono ben note e facilmente riproducibili (ad es. le reazioni di Liesegang, che era un fotografo, sono note dal 1928). Egli cercando di risparmiare Cloruro di Argento nel gel della sua lastra fotografica vide che, anziché precipitare un pallino nero d’argento per la reazione fotochimica, si formavano gli anelli che presero il suo nome e che purtroppo gli sfuocavano la fotografia. Poi capi che il pallino d’argento nero era composto a strati successivi come una cipolla, cosi che per compattarne il comportamento si rese conto che era necessario accelerare la reazione fotosintetica aggiungendo un catalizzatore che riconduceva gli anelli a chiudersi in un pallino nero.
Fino a non molto tempo fa queste osservazioni sono state considerate come curiosità interessanti ma di poco conto scientifico, e pertanto la semplificazione lineare delle trasformazioni chimiche è stata considerata più che sufficiente rispetto all’obiettivo di ottenere grandi quantità nuovi prodotti spendibili nel mercato.
Oggi l’interesse per queste osservazioni sulla ciclicità del fronte di reazione stanno avendo la massima attenzione dei ricercatori. Ciò in quanto il fronte d’onda è una interfaccia bidimensionale che si espande e che va ad assumere spessori cosi sottili in cui, come succede nei “materiali nanometrici”, dove si verificano nuove capacità di grande interesse per le moderne nano-tecnologie, con le quali si esplorano i nuovi sistemi energetici delle trasformazioni chimiche nella dimensione “DIECI alla MENO NOVE”, i quali per molti aspetti dimostrano opportunità applicative ed innovative nello sviluppo della chimica per l’ambiente.(4)
In una prossima lezione potrò relazionarvi sulla “nano-chimica” e sulle nuove ed importanti correlazioni tra concetti e costi/benefici sociali ed economici delle applicazioni tecnologiche della dimensione “Nano” sia in relazione alla salute umana (Nano-medicina) sia per ripulire l’ambiente dall’inquinamento, ma ora … non ho più il tempo assegnatomi per questa conferenza.
Biblio-on line
1) Tavola Periodica Circolare : http://www.focus.it/scienza/scienze/tavole-periodiche-che-non-vi-hanno-fatto-vedere-a-scuola
2) https://www.youtube.com/watch?v=PpyKSRo8Iec; https://reactiondiffusion2016.weblog.tudelft.nl/
3) Liesegang Rings: http://www.edscuola.it/archivio/lre/liesegang_rings.pdf
4) Nano-chimica: https://www.caosmanagement.it/n60/art60_08.html
*Conferenza tenuta a Rosignano Solvay il 2 dicembre 2016.




